在自然界中,生物矿物是通过生物大分子组装体与矿物相之间的动态相互作用形成的纳米结构复合材料。这些精密调控的过程协调矿物的沉积与生长,决定了最终复合材料的物理特性与生物功能。受生物矿化启发,多种蛋白质模板(包括胶原蛋白、淀粉样蛋白和釉原蛋白纳米带)因其在调控矿化过程中的关键作用被广泛研究。这种调控既发生于纤维内部(纤维内矿化),也发生于纤维外部(纤维外矿化),从纳米尺度到介观尺度甚至宏观尺度均发挥作用。纤维内矿化不仅作为生物硬组织形成的基础过程备受关注,更成为开发尖端应用复合纤维材料的理论基础。纤维内矿化介导的复合纤维材料展现出卓越的定向特性、力学性能和光学特性。迄今为止,纤维内矿化现象仅在天然胶原基材料体系中被观察到。该机制通过限域效应将多种矿物颗粒结构化为胶原纤维内高度取向的超结构,在骨形成中起着关键作用。成熟未矿化胶原纤维沿长轴排列形成的通道状间隙(约40 nm长,20 nm高)为羟基磷灰石(HAP)晶体的成核与取向排列提供调控空间,促进矿化进程。相比之下,其他人工及天然超分子纤维(特别是具有β-sheet结构的淀粉样蛋白、釉原蛋白和丝素蛋白纤维)虽具有纤维外矿化活性,但其层级结构缺乏活性间隙区域,很难实现纤维内矿化。因此,合理设计层级结构实现纤维内矿化,不仅能揭示高度有序蛋白支架引导晶体形成的作用机制,更为设计具有定向特性和功能特性的各向异性晶体复合材料提供策略,截至目前,这仍是重大挑战。近期,我院生物表界面与智能大分子研究团队提出了仿生纤维内矿化的新策略。
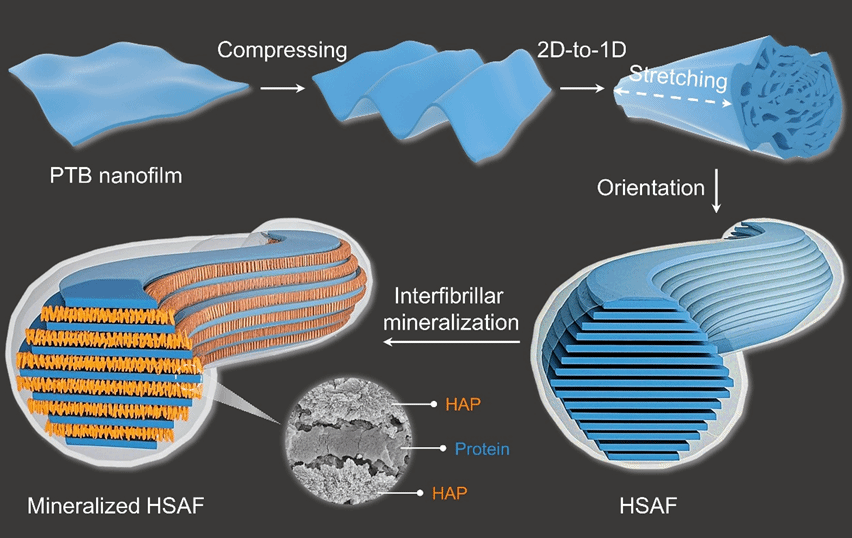
该工作开发了机械力导向的两步转化法,将蛋白质纳米膜转化为具有多层动态适应间隙的分级结构淀粉样纤维(HSAF),实现纤维内矿化。首先利用三(2-羧乙基)膦(TCEP)诱导牛血清白蛋白(BSA)在气/水界面自组装形成蛋白质纳米膜。通过压缩与纵向拉伸的2D → 1D转变,将相变牛血清白蛋白(PTB)纳米膜重构为具有多层结构的HSAF。在此过程中,展开的蛋白链逐渐弛豫并形成各层内的有序β-sheet构象。这种晶体HSAF凭借分级多层结构以及内部亲水界面保持柔性。
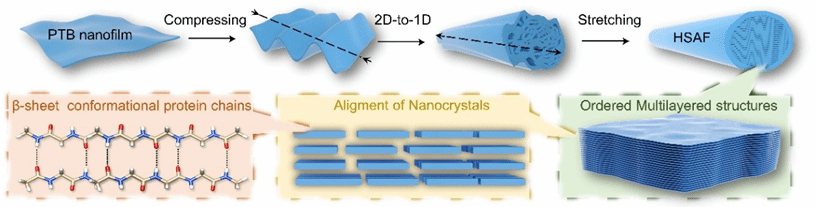
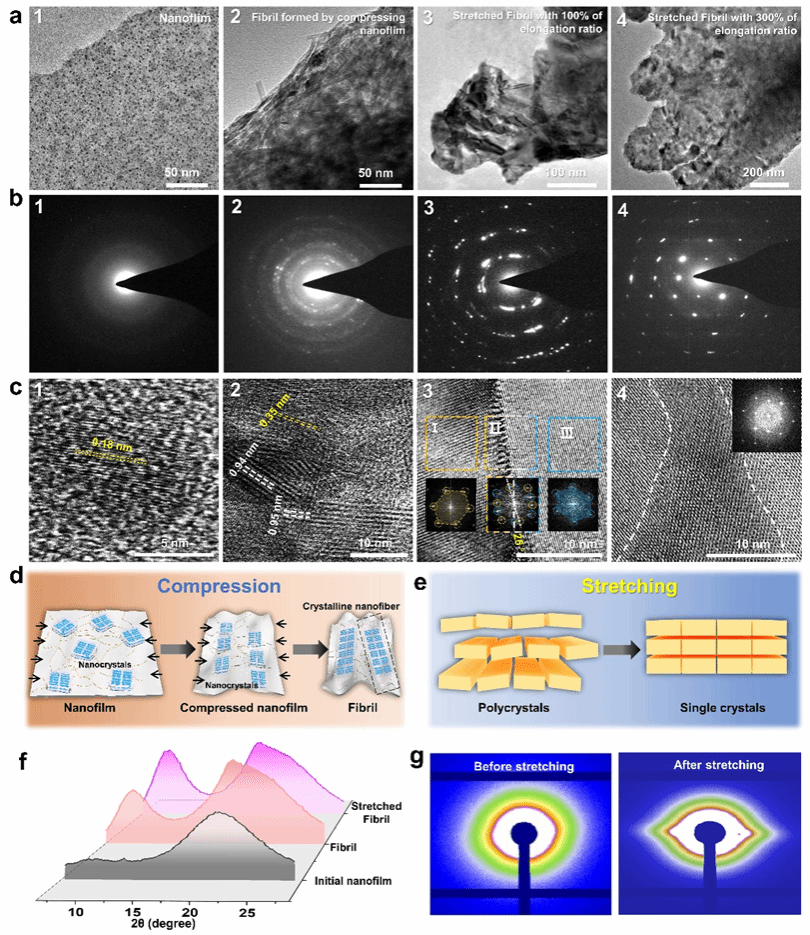
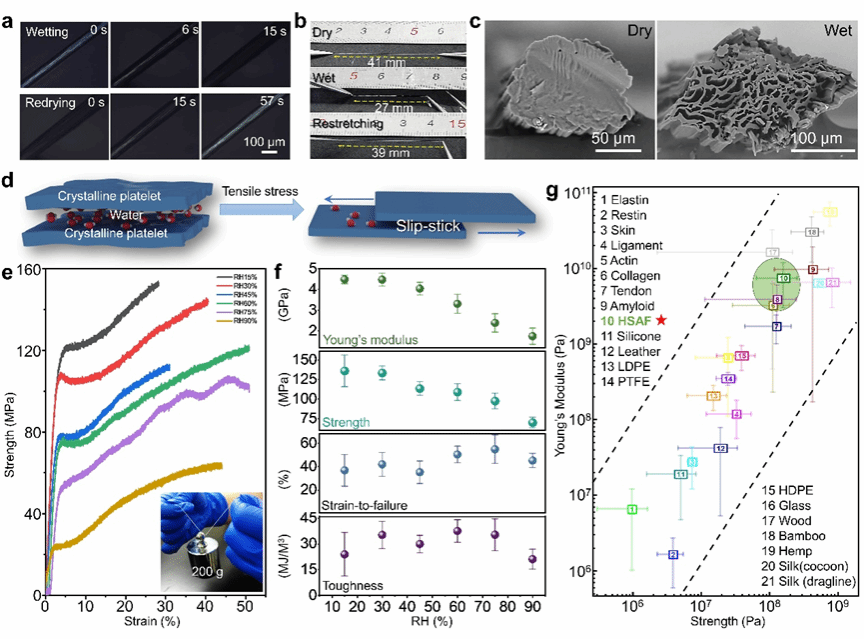
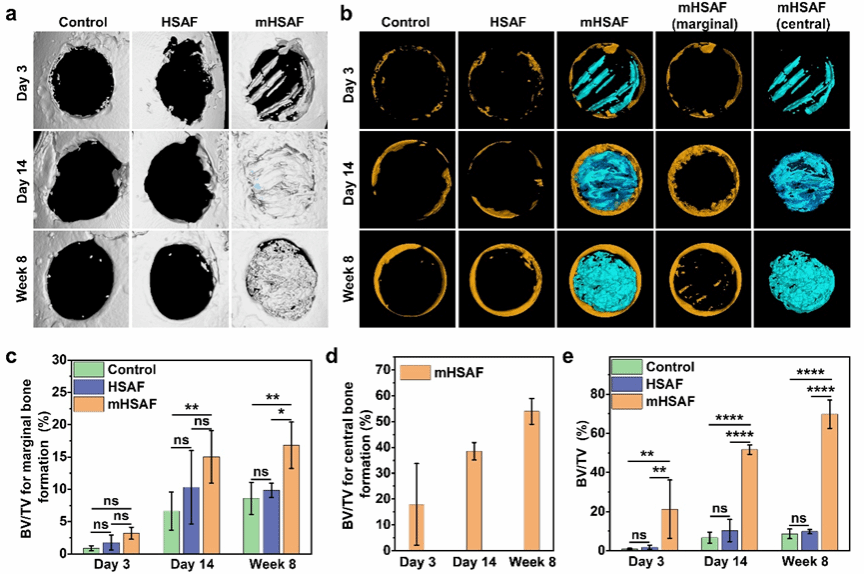
特别地,层间间隙区域由两个整合了聚丙烯酸(PAA)的亲水性负电荷β-sheet晶体界面构成,为HAP矿物提供有效的限域成核与定向排列环境。所得矿化的HSAF(mHSAF)凭借高度有序的蛋白质-HAP组装结构,其硬度(0.616±0.007 GPa)与模量(19.06±3.54 GPa)接近天然的生物硬组织水平,可用作再生材料。不同于以往通过调控局部缺损区炎症反应促进自体组织修复的研究,该材料在小鼠颅骨缺损模型中展现出双重生物活性:既能促进原生骨组织生长,又可引发HSAF进一步的纤维内矿化(由纳米级晶粒矿化为介观尺度晶体)。实验显示两周内实现54.3%的颅骨修复(短期快速封堵),八周达76.9%修复率,其短期快速封堵及长期有效促愈合的效果超越了已报道的3D打印及光热治疗生物支架。
该工作以“Biomimetic Intrafibrillar Mineralization of Hierarchically Structured Amyloid-Like Fibrils”为题发表在《Advanced Materials》上(Adv. Mater. 2025, 2416824)。苗舒婷博士为论文共同第一作者第一位,郭静博士(第四军医大学)为共同第一作者第二位,张悦芯硕士为共同第一作者第三位,杨鹏教授、陶菲副研究员以及第四军医大学轩昆教授为论文通讯作者。

